- 1. Nước là gì?
- 1.1 Nước là gì?
- 1.2 Thành phần hoá học của nước
- 2. Tính chất hóa học của nước
- 2.1 Nước tác dụng với kim loại
- 2.2 Nước tác dụng với oxit bazo
- 2.3 Nước tác dụng với oxit axit
- 3. Nước tham gia phản ứng với một số chất khác
- 4. Tính chất vật lý của nước
- 5. Vai trò của nước là gì?
- 6. Bài tập vận dụng tính chất hoá học của nước
- 6.1 Bài tập 1
- 6.2 Bài tập 2
- 6.3 Bài tập 3
- 6.4 Bài tập 4
- 6.5 Bài tập 5
- 6.6 Bài tập 6
Bạn đang xem : Tính chất hóa học của nước? Vai trò của nước trong đời sống
Hơn 70% diện tích của Trái Đất được bao phủ bởi nước. Vậy tính chất hóa học của nước là gì? Nước có vai trò gì trong cuộc sống? Tất cả sẽ được TamTheThangLong giải đáp trong bài viết sau đây.
Nước là gì?
Nước là gì?
Nước là một hợp chất vô cơ, trong suốt, không vị, không mùi và gần như không màu. Nước là thành phần chính và quan trọng nhất cấu tạo nên sự sống trên Trái Đất.
Ngoài ra, khoảng 70% cơ thể người được bao phủ bởi nước. Nếu cơ thể mất đi lượng nước cần thiết sẽ dẫn đến những hậu quả khôn lường.

Xem thêm : 3 Tính chất hóa học của ankan mà bạn cần phải nắm vững
Thành phần hoá học của nước
Thành phần của nước bao gồm hidro và oxi. Chúng đã hóa hợp với nhau theo tỉ lệ 2 hidro và 1 oxi. Công thức hóa học của nước là H2O.
Sự phân hủy nước: Khi cho dòng điện một chiều đi qua nước, trên bề mặt hai điện cực sinh ra khí hidro và oxi với tỉ lệ thể tích 2:1
2H2O (điện phân) → 2H2 + O2
Tham khảo thêm : Tính chất hóa học của HNO3 là gì? 8 lưu ý khi sử dụng axit nitric HNO3
Sự tổng hợp nước: Đốt bằng tia lửa điện hỗn hợp 2 thể tích hidro và 2 thể tích oxi, ta thấy sau cùng hỗn hợp chỉ còn 1 thể tích oxi. Vậy 1 thể tích oxi đã hóa hợp với 2 thể tích hidro tạo thành nước.
2H2 + O2 (t°) → 2H2O
- Tính chất là gì? 5 tính chất cần biết trong hóa học
- Tính chất hóa học của HNO3 là gì? 8 lưu ý khi sử dụng axit nitric HNO3
Tính chất hóa học của nước
Nước tác dụng với kim loại
Ở nhiệt độ thường, các kim loại tính kiềm mạnh như Li, Na, K, Ba, Ca,… tác dụng với nước dễ dàng tạo thành dung dịch bazơ và khí H2.
Phương trình tổng quát:
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
Ví dụ:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2

Đặc biệt, một số kim loại trung bình như Mg, Al, Zn, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo oxit kim loại và hidro. Ngoài ra, kim loại Mg tan rất chậm trong nước nóng.
Ví dụ:
Mg + H2Ohơi → MgO + H2
3Fe + 4H2Ohơi → Fe3O4+ 4H2
Fe + H2Ohơi → FeO + H2
Nước tác dụng với oxit bazo
Nước tác dụng với oxit bazơ tạo thành dung dịch bazo tương ứng.
Phương trình tổng quát: H2O + Oxit bazơ → Bazơ
Ví dụ:
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
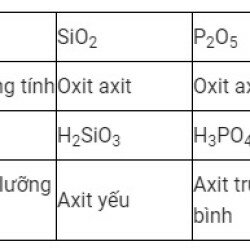
Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng.
Phương trình tổng quát: H2O + Oxit axit → Axit
Ví dụ:
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
Nước tham gia phản ứng với một số chất khác
Ngoài kim loại, oxit bazo và oxit axit, nước tham gia phản ứng với một số chất khác.
Phản ứng với phi kim mạnh: Flo, Clo.
Khi gặp nước đun nóng thì flo bốc cháy.
2F2 + 2H2O → 4HF + O2
2H2O + 2Cl2 →to 4HCl + O2
Một số phản ứng với muối natri aluminat.
3H2O + 2AlCl3 + 3Na2SO3 → 6NaCl + 2Al(OH)3 + 3SO2
H2O + NaAlO2 → NaAl(OH)4
2H2O + NaAlO2 + CO2 → Al(OH)3 + NaHCO3
4H2O + 2NaAlH4 →Na2O + Al2O3+ 8H2
Tính chất vật lý của nước
Tính chất vật lý của nước là:
Ở trạng thái lỏng, nước nguyên chất không có hình dạng nhất định, không màu, không mùi, không vị. Nhiệt độ sôi của nước là 100°C (trong điều kiện áp suất khí quyển là 760 mmHg (1 atm)).
Ở nhiệt độ 0°C, nước sẽ chuyển sang thể rắn (hoá rắn) gọi là nước đá, khác với nước đá khô là CO2 hóa rắn. Khối lượng riêng của nước (ở 4°C) là 1 g/ml (hoặc 1 kg/lít).

Nước là một dung môi phân cực có thể hòa tan rất nhiều chất tan phân cực khác ở cả thể rắn, lỏng, khí như: đường, muối ăn, axit, khí hidro clorua, khí amoniac,…
Tính dẫn điện: Nước tinh khiết (nước cất) không có tính dẫn điện. Tuy nhiên, nước thông thường thường chứa nhiều loại muối tan. Tính dẫn điện của nước sẽ phụ thuộc vào tổng lượng muối trong nước, tính chất các muối và nhiệt độ của nước. Nước khoáng hoá cao thường có tính dẫn điện mạnh.
Tính dẫn nhiệt: Nước có khả năng dẫn nhiệt tốt.
Vai trò của nước là gì?
Vai trò của nước:
Nước rất cần thiết cho đời sống hàng ngày, sản xuất nông nghiệp, công nghiệp, xây dựng, giao thông vận tải,… Sự sống trên Trái Đất đều bắt nguồn từ nước và phụ thuộc vào nước. Nước có ảnh hưởng quyết định đến khí hậu một khu vực và là nguyên nhân tạo ra thời tiết.

Nước là thành phần quan trọng của các tế bào sinh học và là môi trường của các quá trình sinh hóa cơ bản như quang hợp tạo thành khí oxi:
6H2O + 6CO2 → C6H12O6 + 6O2 (quang hợp)
Nước tham gia và nhiều quá trình hoá học quan trọng trong cơ thể người và động vật. Nước chiếm khoảng 70% cơ thể chúng ta. Vì thế, nước chính là một phần tất yếu của cuộc sống.
Bài tập vận dụng tính chất hoá học của nước
Bài tập 1
Chọn đáp án đúng trong các câu sau:
Câu 1: Nước được cấu tạo như thế nào?
A. Từ 1 nguyên tử hidro & 1 nguyên tử oxi
B. Từ 2 nguyên tử hidro & 1 nguyên tử oxi
C. Từ 1 nguyên tử hidro & 2 nguyên tử oxi
D. Từ 2 nguyên tử hidro & 2 nguyên tử oxi
Câu 2: Phân tử nước chứa những nguyên tố nào?
A. Nitơ và Hidro
B. Hidro và Oxi
C. Lưu huỳnh và Oxi
D. Nitơ và Oxi
Câu 3: %m Hidro trong một phân tử nước:
A. 11,1%
B. 88,97%
C. 90%
D. 10%
Câu 4: Chọn câu đúng:
A. Kim loại tác dụng với nước tạo ra bazo tương ứng
B. Nước là chất lỏng không màu, không mùi, không vị
C. Nước làm đổi màu quỳ tím
D. Na tác dụng với H2O không sinh ra H2
Câu 5: Oxit nào sau đây không tác dụng với nước
A. P2O5
B. CO
C. CO2
D. SO3
Câu 6: Oxi bazơ không tác dụng với nước là:
A. BaO
B. Na2O
C. CaO
D. MgO
Bài tập 2
Điền từ hoặc cụm từ thích hợp vào chỗ trống trong các câu sau đây, cho các từ và cụm từ sau: oxit axit, oxit bazo, nguyên tố, hidro, oxi, kim loại.
Nước là hợp chất tạo bởi hai…là…và…Nước tác dụng với một số…ở nhiệt độ thường và một số…tạo ra bazo; tác dụng với nhiều…tạo ra axit.
Trả lời:
Đáp án cần điền lần lượt là: nguyên tố – hidro – oxi – kim loại – oxit bazo – oxit axit.
Bài tập 3
Bằng những phương pháp nào có thể chứng minh được thành phần định tính và định lượng của nước. Viết các phương trình hóa học xảy ra.
Trả lời:
Có thể chứng minh thành phần định tính và định lượng của nước bằng những phương pháp:
- Phương pháp hóa học: dùng dòng điện tách nước, đốt bằng tia lửa điện, hay cho nước tác dụng với một số kim loại ở nhiệt độ thường.
2H2O (điện phân) → 2H2 + O2
2K + 2H2O → 2KOH + H2↑
- Phương pháp vật lí: dựa vào nhiệt độ sôi, nhiệt độ hóa rắn thành đá và tuyết, ta có thể chứng minh được thành phần định tính và định lượng của nước.
Bài tập 4
Tính thể tích khí H2 và O2 (đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
Trả lời:
Phương trình hóa học của phản ứng: 2H2 + O2 (t°) → 2H2O
Ta có, số mol của H2O: nH2O = 1,8 / 18 = 0,1 mol
Theo PTHH, ta có:
- nH2 = nH2O = 0,1 (mol)
- nO2 = (1/2)nH2O = 0,05 (mol)
Thể tích khí H2 và O2 (đktc) cần dùng là:
VH2 = 0,1 x 22,4 = 2,24 (lít)
VO2 = 0,05 x 22,4 = 1,12 (lít)
Vậy cần 2,24 lít khí H2 và 1,12 lít khí O2 để tạo ra được 1,8g nước.
Bài tập 5
Tính khối lượng H2O ở trạng thái lỏng sẽ thu được khi đốt cháy hoàn toàn 112 lít khí H2 (đktc) với khí O2.
Trả lời:
Phương trình hóa học của phản ứng: 2H2 + O2 (t°) → 2H2O
Số mol của H2: nH2 = 112 / 22,4 = 5 mol
Theo PTHH, ta có: nH2O = nH2 = 5 (mol)
Khối lượng của nước thu được: mH2O = 5 x 18 = 90 (g)
Vậy khi đốt cháy 112 lít khí H2 (đktc) với khí O2 sẽ thu được 90g H2O ở trạng thái lỏng.
Bài tập 6
Viết PTHH của các phản ứng tạo ra bazo và axit. Làm thế nào để nhận biết dung dịch axit và bazo?
Trả lời:
PTHH tạo ra bazo:
- Na2O + H2O → 2NaOH
- CaO + H2O → Ca(OH)2
Nhận biết dung dịch bazo bằng quỳ tím. Dung dịch bazo làm quỳ tím hóa xanh.
PTHH tạo ra axit:
- SO2 + H2O → H2SO3
- P2O5 + 3H2O → 2H3PO4
Nhận biết dung dịch axit bằng quỳ tím. Dung dịch axit làm quỳ tím hóa đỏ.
Như vậy chúng ta đã biết được tính chất hóa học của nước là gì và vai trò của nước trong cuộc sống. Nếu thấy hay, đừng quên chia sẻ bài viết của TamTheThangLong nhé!