- 1. Kim loại là gì?
- 1.1 Kim loại là gì?
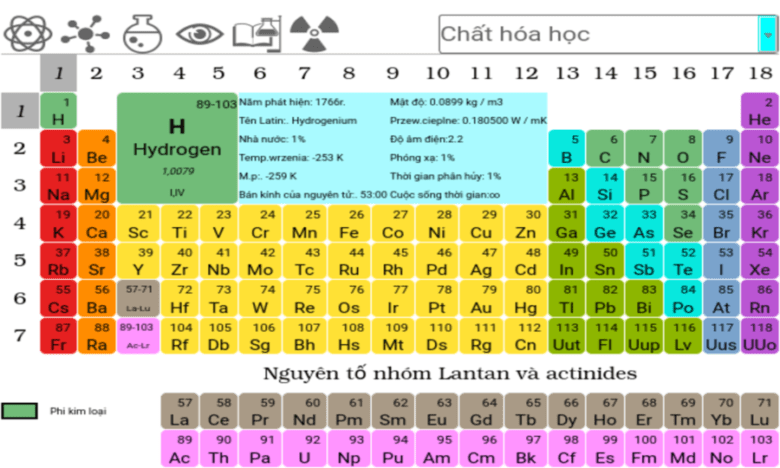
- 1.2 Vị trí của kim loại trong bảng tuần hoàn hoá học
- 1.3 Phân loại kim loại
- 1.4 Cấu tạo của kim loại như thế nào?
- 2. Tính chất hóa học của kim loại
- 2.1 Kim loại tác dụng với oxi
- 2.2 Kim loại tác dụng với các phi kim khác
- 2.3 Kim loại kiềm tác dụng với dung dịch axit
- 2.4 Kim loại kiềm tác dụng với dung dịch muối
- 3. Tính chất vật lý của kim loại
- 4. Ứng dụng của kim loại trong đời sống hiện nay
- 5. Các bài tập về tính chất hoá học của kim loại
Bạn đang xem : Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất
Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất được cập nhật mới nhất tại Tamthethanglong.com. Trang thông tin tổng hợp mới nhất của giới trẻ hiện nay, cập nhật liên tục.
Một trong những vật liệu phổ biến nhất xung quanh chúng ta là kim loại hoặc có thành phần chính từ kim loại (hợp kim). Vậy tính chất hóa học của kim loại là gì? Cùng TamTheThangLong tìm hiểu ngay nhé!
Kim loại là gì?
Kim loại là gì?
Kim loại là metal được dịch từ tên tiếng Anh sang. Kim loại là nguyên tố hóa học trong đó tạo ra ion(+) (cation) và những liên kết kim loại. Những kim loại nằm trong nhóm nguyên tố bởi độ ion hóa và có sự liên kết cùng với hợp kim và á kim.

Cùng TamTheThangLong tiếp tục khám phá vị trí và tính chất hóa học của kim loại ngay nhé!
Vị trí của kim loại trong bảng tuần hoàn hoá học
Vị trí của kim loại trong bảng tuần hoàn hoá học được phân bố qua các nhóm sau đây:
Xem thêm : 520 là gì? Ý nghĩa ngọt ngào của con số 520 trong tình yêu
- Nhóm IA (trừ hiđro) và nhóm IIA.
- Nhóm IIIA (trừ Bo) và một phần của các nhóm IVA, VA, VIA.
- Các nhóm B từ IB đến VIIIB.
- Họ lantan và họ actini được xếp riêng thành hai hàng ở cuối bảng.
Để dễ dàng tìm thấy kim loại mình cần tìm, thì bạn có thể tham khảo bảng tuần hoàn hóa học được bán ở các nhà sách và cửa hàng phẩm.
Vậy trong bảng tuần hoàn có gần 90 nguyên tố kim loại thì tính chất hóa học của kim loại có giống nhau không. Cùng TamTheThangLong đi tìm câu trả lời tiếp nhé!
Phân loại kim loại
Kim loại có 4 loại, mỗi loại có cấu tạo và ứng dụng khác nhau, phục vụ cho mục đích sản xuất khác nhau.
Tham khảo thêm : Tính chất hình thoi? 4 bài tập nhận biết hình thoi
Kim loại cơ bản
Kim loại cơ bản là kim loại dễ bị oxi hóa, ăn mòn và oxi hóa. Ngoài ra, chúng có thể phản ứng hóa học với HCl (axit clohydric dạng loãng).
Một số kim loại cơ bản điển hình là Fe, Zn,… Riêng Cu, mặc dù nó không có phản ứng hóa học với HCl nhưng lại dễ bị oxy hóa. Vì thế, cũng được phân vào nhóm kim loại cơ bản.

Kim loại hiếm
Ngược lại với kim loại cơ bản, những kim loại thuộc nhóm hiếm ít bị ăn mòn bởi oxi và axit. Giá trị của chúng cũng cao hơn nhiều so với các loại kim loại còn lại. Một số kim loại hiếm như Au, Ag,…

Kim loại đen
Kim loại đen là những kim loại màu đen có chứa Fe và có từ tính. Chúng được tạo thành từ 2 nguyên tố chủ yếu là Fe và C. Kim loại đen rất phổ biến và là một trong những kim loại được tái chế nhiều lần.
Ví dụ như gang, thép và các hợp kim từ Fe khác.

Kim loại màu
Kim loại màu là các kim loại có các màu và ánh kim. Chúng có màu đặc trưng riêng và được sản xuất từ quặng màu nguyên sinh hoặc thứ sinh.
Kim loại màu chống ăn mòn tốt hơn kim loại đen, dẫn nhiệt và dẫn điện khá tốt. Nhiệt độ nóng chảy thấp hơn nên khả năng đúc dễ dàng hơn so với kim loại đen.

Cấu tạo của kim loại như thế nào?
Cấu tạo của nguyên tử kim loại:
- Đều có ít số electron ở lớp ngoài cùng ( 1,2 hoặc 3e).
- Trong cùng một chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim.
Qua những câu hỏi trên chắc hẳn bạn đã hiểu rõ hơn về đặc điểm và các loại kim loại hiện nay. Vậy tính chất hóa học của kim loại thể hiện như thế nào, đến cùng phần 2 của TamTheThangLong nhé!
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
- Tính chất hóa học của oxit? Khái quát về 4 loại oxit đặc trưng
Tính chất hóa học của kim loại
Kim loại tác dụng với oxi
Tính chất hóa học của kim loại đầu tiên là tác dụng với oxi. Ở nhiệt độ cao, oxi có thể tác dụng với hầu hết các kim loại để tạo ra các oxit (trừ một số kim loại như Au hay Pt,…).
Ví dụ:
- O2 + 2Mg → 2MgO.
- 3O2 + 4Al → 2Al2O3.
Kim loại tác dụng với các phi kim khác
Tính chất hóa học của kim loại tiếp theo là tác dụng với các phi kim khác. Hầu hết kim loại (trừ Au, Pt, Ag,…) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
Ví dụ:
- 2Ba + O2 → 2 BaO.
- 4Cr + 3O2 →to 2Cr2O3.
Kim loại kiềm tác dụng với dung dịch axit
Kế tiếp tính chất hóa học của kim loại còn thể hiện qua tác dụng với dung dịch axit.
Nhiều kim loại tác dụng với dung dịch axit (HCl,…) tạo thành muối và H2.
Ví dụ:
- Mg + 2 HNO3 → MgNO32 +H2.
- 2Al + 6HNO3 → 2 AlNO33 + 3H2.
Tác dụng với dung dịch HNO3 và H2SO4 đặc nóng.
- Kim loại tác dụng dung dịch HNO3 đặc nóng tạo muối nitrat và nhiều loại khí như NO2, NO, N2O, N2 và muối NH4NO3.
M + HNO3 → MNO3n+NO2,NO,N2O,N2,NH4NO3 + H2O
Ví dụ: Cu + 4HNO3đặc nóng→ CuNO32 + 2NO2 + 2H2O
- Kim loại tác dụng với dung dịch H2SO4 đặc nóng tạo muối sunfat và nhiều loại khí như SO2 H2S và S.
M + H2SO4 đặc, nóng→ M2SO4n+SO2,S,H2S + H2O
Ví dụ: 2Al + 6H2SO4 đặc, nóng → Al2SO43 + 3SO2↑ + 6H2O
Lưu ý: Al, Fe, Cr thụ động với H2SO4 đặc nguội và HNO3 đặc nguội.
Kim loại kiềm tác dụng với dung dịch muối
Cuối cùng tính chất hóa học của kim loại là tác dụng với dung dịch muối. Phản ứng của kim loại với dung dịch muối còn được gọi là phản ứng thuỷ luyện. Khi cho kim loại vào dung dịch muối thì xảy ra các khả năng sau:
Nếu kim loại là Na, K, Ba, Ca (hoặc một số kim loại kiềm, kiềm thổ khác).
- Kim loại tác dụng với nước tạo thành dung dịch kiềm và H.
- Sau đó kiềm mới tác dụng với dung dịch muối (phản ứng chỉ xảy ra nếu sau phản ứng có kết tủa, bay hơi hoặc điện ly yếu).
Với các kim loại khác
- Khi cho các kim loại khác vào dung dịch muối thì phản ứng tuân theo quy tắc alpha (α).
- Kim loại đứng trước đẩy kim loại đứng sau khỏi dung dịch.
- Tuy nhiên ta cũng cần lưu ý đến các cặp oxi hóa – khử của Fe.
Lưu ý: Trường hợp nếu có nhiều kim loại hoặc dung dịch chứa nhiều muối thì áp dụng quy tắc alpha dài trước, alpha ngắn sau.

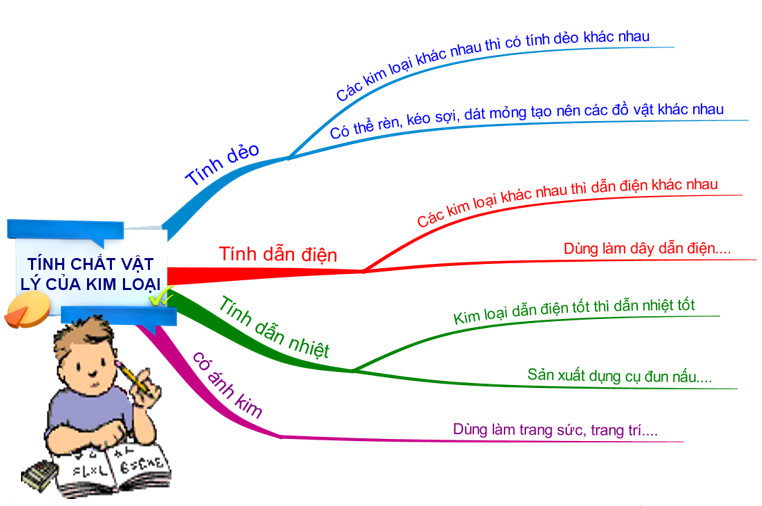
Tính chất vật lý của kim loại
Bên cạnh tính chất hóa học của kim loại thì kim loại cũng có tính vật lý riêng như sau:
Ánh kim
- Kim loại có màu ánh kim.
- Nhờ tính chất sáng lấp lánh, một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
Tính dẻo
- Kim loại có tính dẻo, dễ dát mỏng và kéo thành sợi có thể tạo hình nhiều vật dùng khác nhau.
- Kim loại có độ dẻo cao như Au, Ag, Al, Cu, Sn,…
Tính dẫn nhiệt
- Kim loại có tính dẫn nhiệt tốt.
- Kim loại khác nhau có tính dẫn nhiệt khác nhau.
- Dó có tính dẫn nhiệt và một số tính chất khác, nhôm, thép không gỉ (inox) được dùng để làm dụng cụ nấu ăn.
Tính dẫn điện
- Kim loại có tính dẫn điện tốt. Các kim loại khác nhau có khả năng dẫn điện khác nhau.
- Kim loại có khả năng dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,…
- Do có tính dẫn điện, một số kim loại được sử dụng làm dây dẫn điện. Ví dụ như: Cu, Al,…
Lưu ý: Không nên sử dụng dây dẫn điện trần hoặc dây điện đã bị hỏng lớp bọc cách điện. Để tránh người sử dụng bị điện giật, hay cháy do chập điện,…
Ứng dụng của kim loại trong đời sống hiện nay
Từ tính chất hóa học của kim loại ngày nay ứng dụng của kim loại trong đời sống rất đa dạng. Những dụng cụ làm từ loại kim loại giúp giải quyết được nhiều vấn đề bất tiện trong cuộc sống hằng ngày như:
- Kim loại được dùng để tạo thành vỏ máy bay do độ bền chắc và tính mỏng nhẹ của nó.
- Kim loại cũng thường được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như là nồi, chảo, các loại cửa, các đường dây tải điện,…
- Kim loại là thành phần chính của bình ắc quy thường được sử dụng cho các loại xe.
- Kim loại được dùng làm các nguyên liệu trong một số ngành công nghiệp sản xuất và các vật dụng phổ biến.
- Kim loại là chất nhuộm trắng dùng trong tạo ra sơn.
- Kim loại là một trong những thành phần tạo màu trong khi tráng men. Đặc biệt là tạo màu vàng và màu đỏ – Chì còn được dùng để làm ra tấm ngăn chống lại phóng xạ hạt nhân.
Như vậy, có thể nói rằng các kim loại được sử dụng rộng rãi trong mọi ngành nghề khác nhau. Lưu ý rằng, trong khi xảy ra quá trình tiếp xúc với kim loại thì cần phải cẩn thận.
Các bài tập về tính chất hoá học của kim loại
Cùng TamTheThangLong củng cố kiến thức qua các bài tập về tính chất hoá học của kim loại sau nhé!
Bài 1. Đốt cháy hoàn toàn 3 gam hỗn hợp T gồm Al và Cu cần vừa đủ 1,456 lít hỗn hợp khí gồm O2 và Cl2 thu được 6,64 gam chất rắn. Phần trăm khối lượng của Al trong T là?
Hướng dẫn giải bài 1:
Áp dụng định luật bảo toàn khối lượng => mO2 + mCl2 = m Chất rắn – m KL = 6,64 – 3 = 3,64 gam.
Ta có: n O2 + n Cl2 = 1,456 : 22,4 = 0,065 (mol).
Gọi số mol O2, Cl2 lần lượt là a, b.
=> Ta có hệ phương trình:
a + b = 0,065
32a + 71b = 3,64
=> Giải hệ phương trình được kết quả a = 0,025 ; b = 0,04.
Gọi số mol Al, Cu lần lượt là x, y.
Áp dụng định luật bảo toàn electron:
=> Tổng lượng e nhường của KL bằng tổng lượng e nhận của phi kim (O2, Cl2)
=> 3x + 2y = 4. nO2 + 2. nCl2
=> 3x + 2y = 4. 0,025 + 2. 0,04 = 0,18 (I)
Khối lượng của 2 kim loại bằng 3 gam
=> 27x + 64y = 3 (II)
Từ (I) và (II) => x = 0,04 ; y = 0,03
% Al = (0,04 . 27) : 3 . 100% = 36%
Bài 2. Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là bao nhiêu?
Hướng dẫn giải bài 2:
Dựa vào tính chất hóa học của kim loại ta có PTHH: KL + H2SO4 → Muối + H2
Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol
Bảo toàn khối lượng
→ mmuối = mKL + mH2SO4 – mH2 = 1,9 + 0,06.98 – 0,06.2 = 7,66 gam
Bài 3. Cho thanh sắt Fe vào dung dịch X chứa 0,1 mol AgNO3 và 0,2 mol Cu(NO3)2. Khi thấy thanh kim loại tăng lên 8,8 gam thì dừng lại. Tính khối lượng kim loại bám vào thanh sắt?
Hướng dẫn giải bài 3:
nAg+ = 0,1 mol; nCu2+ = 0,2 mol
Nếu Ag+ phản ứng hết, dựa vào tính chất hóa học của kim loại ta có PTHH:
Fe + 2Ag+ → Fe2+ + 2Ag
0,05 ← 0,1 → 0,1
=> m tăng = 0,1.108 – 0,05.56 = 8 < 8,8
=> Ag+ phản ứng hết; Cu2+ phản ứng 1 phần
Dựa vào tính chất hóa học của kim loại ta có PTHH:
Fe + Cu2+ → Fe2+ + Cu
x → x → x
=> mtăng = 64x – 56x = 8x
=> tổng khối lượng tăng ở 2 phản ứng là:
m tăng = 8 + 8x = 8,8 => x = 0,1 mol
=> mkim loại bám vào = mAg + mCu = 17,2 gam
Bài 4. Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Dựa vào tính chất hóa học của kim loại. Hãy viết PTHH và tính khối lượng của Cu trong hỗn hợp X là bao nhiêu?
Hướng dẫn giải bài 4:
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng.
Dựa vào tính chất hóa học của kim loại ta có PTHH: Al + NaOH + H2O → NaAlO2 + 3/2 H2
Ta có: nAl = 2/3.nH2 = 2/3.0,3 = 0,2 (mol)
→ mCu = mX – mAl = 11,8 – 0,2. 27 = 6,4 (g)
Bài 5. Dựa vào tính chất hóa học của kim loại, hãy viết các phương trình hóa học biểu diễn các chuyển hóa sau đây:
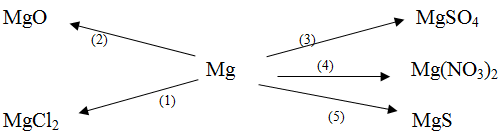
Hướng dẫn giải bài 5:
Dựa vào tính chất hóa học của kim loại ta có các PTHH:
(1) Mg + Cl2 → MgCl2
(2) 2Mg + O2 → 2MgO
(3) Mg + H2SO4loãng → MgSO4 + H2 ↑
(4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag ↓
(5) Mg + S → MgS
Bài 6. Dựa vào tính chất hóa học của kim loại. Hãy viết các phương trình hóa học xảy ra giữa các cặp chất sau đây:
- Kẽm + axit sunfuric loãng.
- Kẽm + dung dịch bạc nitrat.
- Natri + lưu huỳnh.
- Canxi + clo.
Hướng dẫn giải bài 6:
Dựa vào tính chất hóa học của kim loại ta có các PTHH:
- Zn + H2SO4loãng → ZnSO4 + H2↑.
- Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
- 2Na + S → Na2S.
- Ca + Cl2 → CaCl2.
Bài 7. Dựa vào tính chất hóa học của kim loại. Hãy hoàn thành các phương trình hóa học sau đây:
- … + HCl -⇒ MgCl2 + H2.
- … + AgNO3 ⇒ Cu(NO3)2 + Ag.
- … + … ⇒ ZnO.
- … + Cl2 ⇒ HgCl2.
- … + S ⇒ K2S.
Hướng dẫn giải bài 7:
Phương trình hóa học:
- Mg + 2HCl → MgCl2 + H2 ↑.
- Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓.
- 2Zn + O2 → 2ZnO.
- Hg + Cl2 → HgCl2.
- 2K + S → K2S.
Bài 8. Dựa vào tính chất hóa học của kim loại. Hãy dự đoán hiện tượng và viết phương trình hóa học xảy ra, khi:
- Đốt dây sắt trong khí clo.
- Cho một đinh sắt vào trong ống nghiệm đựng dung dịch CuCl2.
- Cho một viên kẽm vào dung dịch CuSO4.
Hướng dẫn giải bài 8:
- Hiện tượng: Fe cháy sáng trong khí Cl2 và có khói màu nâu đỏ tạo thành. PTHH: 2Fe + 3Cl2 → 2FeCl3.
- Dung dịch CuCl2 nhạt màu xanh, kim loại màu đỏ bám vào đinh sắt. PTHH: Fe + CuCl2 → FeCl2 + Cu ↓.
- Zn tan dần, dung dịch CuSO4 nhạt màu xanh, kim loại màu đỏ bám vào viên kẽm. PTHH: Zn + CuSO4 → ZnSO4 + Cu ↓.
Bài 9. Ngâm một lá kẽm trong 20 g dung dịch muối đồng sunfat 10% cho đến khi kẽm không tan được nữa. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Hướng dẫn giải bài 9:
Ta có:
mCuSO4 = 20.0,1 = 2(g) => nCuSO4 = 0,0125 (mol)
Dựa vào tính chất hóa học của kim loại ta có PTHH:
Zn + CuSO4 → ZnSO4 + Cu ↓
0,0125 ← 0,0125 → 0,0125 mol
=> mZn = n.M = 0,0125. 65 = 0,81 (g)
mZnSO4 = n.M = 0,0125. 161= 2,0125 (g)
m dd sau phản ứng = mddCuSO4 + mZn – m Cu giải phóng = 20,0125 gam.
Nồng độ % dung dịch ZnSO4 là:
C% = (2,0125/20,0125).100% = 10,056 (%)
Bài 10. Ngâm một lá đồng trong 20 ml dung dịch bạc nitrat cho tới khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì thấy khối lượng lá đồng tăng thêm 1,52 g. Hãy xác định nồng độ mol của dung dịch bạc nitrat đã dùng (giả thiết toàn bộ lượng bạc giải phóng bám hết vào lá đồng).
Hướng dẫn giải bài 10:
Gọi x là mol kim loại Cu đã phản ứng
Dựa vào tính chất hóa học của kim loại ta có PTHH:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
x mol → 2x mol
→ 2x.108 – 64x = 1,52 → x = 0,01 mol Þ mol AgNO3 đã dùng = 0,02 mol.
Nồng độ dung dịch AgNO3: CM AgNO3 = n/V = 0,02/0,02 = 1 (M)
Hy vọng các bạn biết được kim loại là gì và các bài tập về tính chất hoá học của kim loại. Đừng quên share và follow bài viết để TamTheThangLong có thêm động lực chia sẻ kiến thức nữa nhé.
Trên đây là bài viết Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất được Tâm Thế Thăng Long chia sẻ và cập nhật mới nhất. Chúc các bạn có những thông tin thật thú vị tại Tamthethanglong.com.