Bạn đang xem : Công thức tính số mol – Bài tập minh họa về số mol Hóa học lớp 8
Công thức tính số mol – Bài tập minh họa về số mol Hóa học lớp 8 được cập nhật mới nhất tại Tamthethanglong.com. Trang thông tin tổng hợp mới nhất của giới trẻ hiện nay, cập nhật liên tục.
Từ công thức tính số mol cơ bản có thể giúp học sinh áp dụng để giải một số bài tập lý thuyết và tính toán từ đơn giản đến vận dụng cao. Cùng TamTheThangLong nắm rõ lý thuyết và một số dạng bài tập nhé!
Số mol là gì?
Số mol là một đơn vị đo lường cơ bản thuộc vào hệ quy chuẩn SI và được sử dụng riêng cho các hạt vĩ mô. Nó cách khác, mol chính là lượng chất có chứa số hạt đơn vị của phân tử hoặc nguyên tử chất đó.

Cụ thể nó diễn tả lượng chất có chứa 6,022×10^23 số hạt đơn vị của phân tử hoặc nguyên tử chất đó. Khi làm bài tập hóa học, tính số mol có thể áp dụng tính được nhiều đại lượng quan trọng của chất.
Ví dụ như khối lượng chất, khối lượng mol chất, thể tích, áp suất,…
Xem thêm : Dấu hiệu nhận biết hình thoi? Tính chất, các cách chứng minh
Các công thức tính số mol
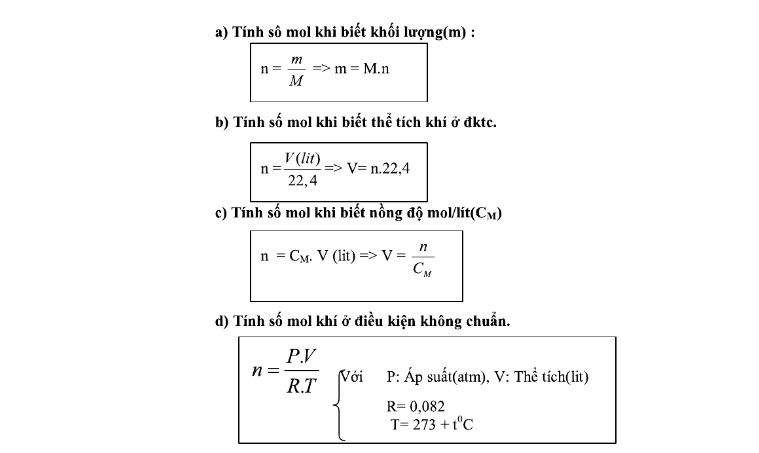
Các công thức tính số mol học sinh có thể tham khảo như:
- n= m : M
- n = V : 22,4
- n = CM . V
- n=A/N
- n= P.V/R.T
Trong đó:
- n: Số mol chất (mol)
- m: Khối lượng chất (g)
- M: Khối lượng mol chất (đvC)
- CM: Nồng độ mol (M)
- A: Số nguyên tử hoặc phân tử
- N: Số Avogađro = 6.10 mũ 23
- P: Áp suất
- R: Hằng số
- T: Nhiệt độ
Cách tính số mol dư
Cách tính số mol dư
Tính số mol dư thường gặp ở dạng khi đề yêu cầu xác định chất nào còn dư trong phản ứng.
Tham khảo thêm : M là gì trong Hóa học? Một số công thức liên quan đến m và M
Công thức: Số mol chất dư = Tổng số mol bài cho – Tổng số mol đã phản ứng
Lưu ý:
- Tổng số mol đã phản ứng chỉ lấy ở những chất đã phản ứng hết. Để nhận biết chất nào phản ứng hết thì thông thường các bạn lấy số mol chất nào nhỏ nhất. Tuy nhiên không phải lúc nào cách chọn như vậy cũng đúng.
- Ngoài ra trong quá trình tính số mol, học sinh cũng cần phải chú ý đến việc cân bằng các phương trình, cân bằng hóa trị.
Bài tập minh họa về số mol
Tổng hợp công thức tính số mol cực hay, có lời giải chi tiết!
Bài 1: Tính số mol nguyên tử hoặc số mol phân tử trong các lượng chất sau:
a) 2,64.10 mũ 23 phân tử H2O
b) 36.10 mũ 23 nguyên tử K
Đáp án hướng dẫn giải chi tiết
a) Số mol phân tử H2O bằng:
nH2O = 2,64.10 mũ 23 / NA = 2,64.10 mũ 23 / 6.10 mũ 23 = 0.44 (mol) phân tử H2O
b) Số mol nguyên tử Mg bằng:
n Mg = 36.10 mũ 23 / NA = 36.10 mũ 23 / 6.10 mũ 23 = 6 (mol) nguyên tử Mg
Bài 2: Tính số mol nguyên tử có trong 18.1023 nguyên tử oxi?
Số mol nguyên tử có trong 9.10 mũ 23 nguyên tử oxi là:
n = A/N = 18.10 mũ 23 / 6.10 mũ 23 = 3 mol
Bài 3: Tính số mol phân tử có trong 100 gam CaCO3?
Số mol phân tử có trong 100 gam CaCO3 là:
nCaCO3 = mCaCO3/ MCaCO3 = 100/100 = 1,0 mol
Bài 4: Số mol phân tử N2 có trong 140 gam khí Nitơ?
Số mol phân tử N2 có trong 140 gam khí Nitơ là:
nN2 = mN2/ M (N2) = 140/28 = 5 mol
Bài 5: Tính số mol phân tử có trong 22,4 lít khí H2S (đktc)?
Số mol phân tử có trong 22,4 lít khí H2S (đktc) là:
nH2S = V (H2S) : 22,4 = 1,0 mol
Bài 6: Số mol chất tan có trong 500 ml BaOH 6M?
Đổi: 500 ml = 0,5 lít
Số mol chất tan có trong 500 ml BaOH 6M là:
Áp dụng công thức: n = CM.V = 6.0,5 = 3 mol
Bài 7: Cho 2,3 gam Natri vào dung dịch HCl dư. Tính thể tích khí H2 thu được ở điều kiện chuẩn
Phản ứng xảy ra theo 2 phương trình
2Na + 2HCl → 2NaCl + H2 ↑ (1)
2Na + 2H2O → 2NaKOH + H2 ↑ (2)
Số mol Kali: nNa= 0,23/23 = 0,01 mol
Theo phương trình phản ứng (1) và (2), nH2 = nNa = 0,01 mol
Vậy thể tích khí hydro thu được ở điều kiện tiêu chuẩn là: VH2 = 0,01 . 22,4 = 0,224 lít
Bài 8: Tính thể tích của các chất khí sau (Đo ở điều kiện tiêu chuẩn)
a) 0,03 mol SO2, 0,15 mol HCl
b) 0,125 mol CO2, 1,2 mol H2SO4
Đáp án
a) Áp dụng công thức tính số mol ta có:
mSO2 = 0,03.22,4 = 0,672 lít
mHCl= 0,15.22,4 = 3,36 lít
b) mCO2 = 0,125 .22,4 = 2,8 lít
mH2SO4 = 1,2 .22,4 = 26,88 lít
Bài 9
a) Phải lấy bao nhiêu gam KOH để được số phân tử bằng số nguyên tử có trong 2,4 gam Magie?
b) Phải lấy bao nhiêu gam NaCl để có số phân tử bằng số phân tử có trong 4,48 lít khí CO2 (đktc)?
Đáp án hướng dẫn giải chi tiết
a) Áp dụng công thức tính số mol ta có:
nMg = m/M = 2,4/24 = 0,1 mol
nKOH = nMg ⇒ nKOH = nMg = 0,1 mol
mKOH = n.M = 0,1.56 = 5,6gam
b) nCO2 = 4,48/22,4 = 0,2 mol
nNaCl = nCO2 ⇒ nNaCl = nCO2 = 0,2 mol
mNaCl = n.M = 0,2.58,5 = 11,7 gam
Bài 10: Tính khối lượng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,2M
Đổi 300 ml = 0,3 lít
Số mol chất tan có trong 300 ml Ba(OH)2 0,6M là:
nBa(OH)2 = CM.V = 0,3.0,6 = 0,18 mol
Khối lượng Ba(OH)2 có trong dung dịch là:
mBa(OH)2 = 171 . 0,18 = 30,78 gam
Trên đây là toàn bộ thông tin liên quan đến câu hỏi công thức tính số mol và một số bài tập minh họa về số mol. Đừng quên theo dõi những bài viết tiếp theo của TamTheThangLong bạn nhé!
Trên đây là bài viết Công thức tính số mol – Bài tập minh họa về số mol Hóa học lớp 8 được Tâm Thế Thăng Long chia sẻ và cập nhật mới nhất. Chúc các bạn có những thông tin thật thú vị tại Tamthethanglong.com.