- 1. Oxi là gì?
- 1.1 Oxi là gì?
- 1.2 Thông tin cơ bản về nguyên tố oxi
- 2. Tính chất của oxi là gì?
- 3. Tính chất vật lý của oxi
- 4. Tính chất hoá học của oxi? Viết phương trình minh hoạ
- 4.1 Oxi tác dụng với kim loại
- 4.2 Oxi tác dụng với phi kim
- 4.3 Oxi tác dụng với hợp chất
- 5. Bài tập minh hoạ về tính chất của oxi
- 5.1 Bài 1 trang 84 SGK Hóa 8
- 5.2 Bài 2 SGK Hóa 8 trang 84
- 5.3 Bài 3 SGK Hóa 8 trang 84
- 5.4 Bài 4 SGK Hóa 8 trang 84
- 5.5 Bài 5 SGK Hóa 8 trang 84
- 5.6 Bài 6 trang 84 SGK Hóa học 8
Bạn đang xem : Tính chất của oxi chương trình lớp 8 – Bài tập minh họa
Tính chất của oxi chương trình lớp 8 – Bài tập minh họa được cập nhật mới nhất tại Tamthethanglong.com. Trang thông tin tổng hợp mới nhất của giới trẻ hiện nay, cập nhật liên tục.
Oxi chiếm bao nhiêu trong không khí? Liệu oxi có phải là vô tận và là thành phần chủ yếu trong không khí? Qua bài viết sau của TamTheThangLong sẽ trình bày chi tiết về các tính chất của oxi nhé!
Oxi là gì?
Oxi là gì?
Oxi hay còn gọi là oxy, ôxi, oxygen là nguyên tố phổ biến nhất theo khối lượng trong vỏ Trái Đất (49% khối lượng vỏ Trái Đất). Còn khí oxi là chất khí chiếm thể tích thứ 2 trong không khí sau nitơ.
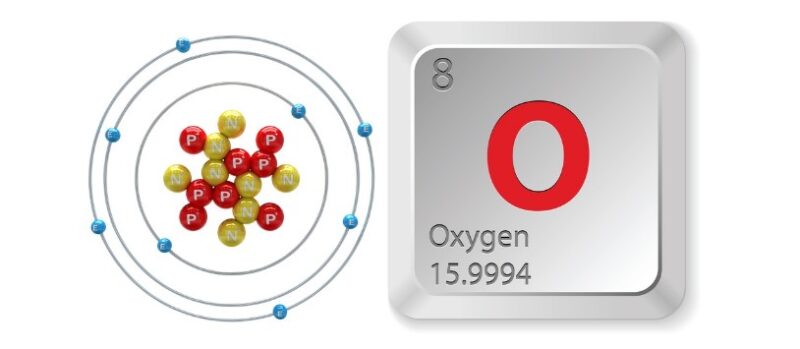
Thông tin cơ bản về nguyên tố oxi
Theo hoá học thì oxi thuộc cấu hình e, có nguyên tử là 1s2s2p4. Oxi ở trong điều kiện tự nhiên có 3 đồng vị: 16, 17 và 18. Công thức cấu tạo của phân tử oxi có thể viết là: O=O.
Tiếp đến, bạn có thể tìm thấy oxi ở trong các hợp chất. Đặc biệt nhất là các tính chất hoá học của oxit kim loại như SiO3 và CO3.
Xem thêm : 520 là gì? Ý nghĩa ngọt ngào của con số 520 trong tình yêu
Oxi có vai trò vô cùng to lớn trong cơ thể người và sinh vật như:
- Oxi là nguyên liệu cho quá trình đốt cháy tạo năng lượng để sinh công cho các cơ quan hoạt động, duy trì thân nhiệt.
- Oxi tham gia vào phản ứng biến dưỡng và nhiều phản ứng sinh hóa khác.
- Tất cả các nhóm phân tử cấu trúc chính trong các cơ thể sống như các protein, cacbohydrat và mỡ đều chứa oxi.
- Trong các hợp chất vô cơ quan trọng cấu tạo tạo nên các răng và xương.
Qua những thông tin trên chắc hẳn bạn đã biết sơ về khái niệm và một chút thông tin về nguyên tố oxi. Vậy hãy cùng TamTheThangLong đi sau chi tiết tính chất của oxi là gì nhé!
Tính chất của oxi là gì?
Tính chất của oxi là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
Tham khảo thêm : 3 Tính chất hóa học của oxi quan trọng mà bạn cần nắm vững
Có một số nghiên cứu oxi với không khí có tỉ khối là 32:29. Oxi tan rất ít trong nước. Nước ở nhiệt độ 20 độ C với 100ml, 1atm sẽ hoà tan được 3,1ml oxi. Khí oxi ở 20 độ C và 1atm sẽ có độ tan là 0,0043g tỉ trọng 100g H2O.
Bên cạnh đó oxi có nhiều tính chất quan trọng và nổi bật. Tính chất của oxi được thể hiện qua tính chất vật lý và tính chất hoá học của oxi. Cùng TamTheThangLong đi vào chi tiết từng tính chất của oxi nhé!
Tính chất vật lý của oxi
Tính chất của oxi đầu tiên phải kể đến là tính chất vật lý:
- Tỉ khối của oxi đối với không khí: dO2/kk = 32/29.
- 1 lít nước (ở 20°C) hòa tan được 31 ml khí oxi.
- Oxi tồn tại ở cả dưới dạng đơn chất và hợp chất.
- Ở dạng đơn chất, oxi có nhiều trong không khí.
- Người ta điều chế khí oxi từ không khí hoặc từ điện phân nước.
Tính chất hoá học của oxi? Viết phương trình minh hoạ
Tính chất của oxi quan trọng và đặc biệt là tính chất hoá học. Được thể hiện qua những phương trình minh hoạ sau đây.
Oxi tác dụng với kim loại
Oxi có thể tác dụng với khá nhiều kim loại dưới tác dụng của nhiệt độ. Để tạo ra các oxit (trừ một số kim loại như bạc (Ag) vàng (Au) hay bạch kim (Pt).
Phương trình minh hoạ:
- S + O2 (t°) → SO2.
- 4P + 5O2 (t°) → 2P2O5.
- 2H2 + O2 (t°) → 2H2O.
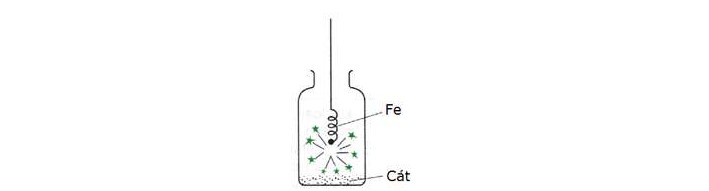
Ví dụ: Đốt cháy sắt trong bình oxi, dây sắt cháy sáng như pháo hoa, sau khi cháy xuất hiện oxit màu nâu đỏ.
PTHH: 3Fe + 2O2 → Fe3O4
Oxi tác dụng với phi kim
Oxi tác dụng với khá nhiều phi kim trong tự nhiên và với những điều kiện khác nhau. Chỉ trừ nhóm halogen (Flo, Clo, Brom và Atatin) là oxi không phản ứng và sản phẩm tạo thành là các oxit axit.
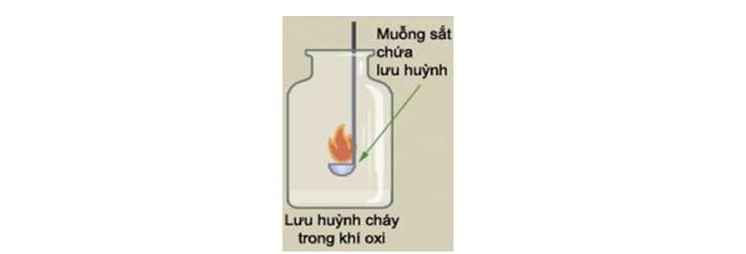
Ví dụ: Đưa muối sắt có chứa bột lưu huỳnh vào ngọn lửa đèn cồn. Sau đó đưa lưu huỳnh đang cháy vào lọ thuỷ tinh có chứa khí oxi. Lưu huỳnh cháy trong khí oxi mãnh liệt hơn cháy trong không khí, cho ngọn lửa màu xanh.
PTHH: S+O2 (t°) → SO2
Phương trình minh hoạ:
- 3Fe + 2O2 (t°) → Fe3O4.
- 2Cu + O2 (t°) → 2CuO.
- 2Mg + O2 (t°) → 2MgO.
Oxi tác dụng với hợp chất
Oxi còn có thể tác dụng với các chất có tính khử hoặc các hợp chất hữu cơ để tạo thành những hợp chất mới.
Ví dụ: Khí metan có trong khí bùn ao, phản ứng cháy của metan trong không khí tạo thành khí cacbonic, nước, đồng thời toả nhiều nhiệt.
PTHH: CH4 + 2O2 →t0 CO2 + 2H2O.
Phương trình minh hoạ:
- CH4 + 2O2 (t°) → CO2 + 2H2O.
- 4FeS2 + 11O2 (t°) → Fe2O3 + 8SO2.

Bài tập minh hoạ về tính chất của oxi
Sau khi ôn lại kiến thức về khái niệm và tính chất của oxi. Thì cùng TamTheThangLong củng cố lại kiến thức qua một số bài tập minh hoạ về tính chất của oxi ngay nhé!
Bài 1 trang 84 SGK Hóa 8
Dùng từ thích hợp trong khung để điền vào chỗ trống trong các câu sau: Kim loại, phi kim, rất hoạt động, phi kim rất hoạt động, hợp chất.
Khí oxi là một đơn chất ..……….. Oxi có thể phản ứng với nhiều ……………., ……………, ……………..
Hướng dẫn giải bài 1:
Áp dụng tính chất của oxi, ta có:
Khí oxi là một đơn chất phi kim rất hoạt động. Oxi có thể phản ứng với nhiều phi kim, kim loại, hợp chất.
Bài 2 SGK Hóa 8 trang 84
Dựa vào tính chất của oxi nêu các thí dụ chứng minh rằng oxi là đơn chất rất hoạt động (đặc biệt ở nhiệt độ cao).
Hướng dẫn giải bài 2:
Ví dụ: Phản ứng với lưu huỳnh, cháy với ngọn lửa màu xanh nhạt; phản ứng với photpho hay sắt,…
Phương trình hóa học:
- 3Fe + 2O2 → Fe3O4.
- S + O2 → SO2.
Bài 3 SGK Hóa 8 trang 84
Butan có công thức C4H10khi cháy tạo ra khí cacbonic và hơi nước, đồng thời tỏa nhiều nhiệt. Dựa vào tính chất của oxi hãy viết phương trình hóa học biểu diễn sự cháy của butan.
Hướng dẫn giải bài 3:
Phương trình hóa học:
2C4H10 + 13O2→ 8CO2+ 10H2O + Q (Q là nhiệt lượng).
Bài 4 SGK Hóa 8 trang 84
Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, màu trắng).
a) Photpho hay oxi, chất nào còn thừa và số mol chất còn thừa là bao nhiêu?
b) Chất nào được tạo thành, khối lượng là bao nhiêu?
Hướng dẫn giải bài 4:
a) Áp dụng tính chất của oxi vào bài ta có:
Số mol photpho: nP= 12,4/31 = 0,4 (mol).
Số mol oxi: nO= 17/32= 0,53 (mol).
Phương trình phản ứng:
4P + 5O2→ 2P2O5
0,4→ 0,5→ 0,2 (mol)
Vậy số mol oxi còn thừa lại là: 0,53 – 0,5 = 0,03 (mol).
b) Chất được tạo thành là P2O5. Theo phương trình phản ứng, ta có:
nP2O5 = 1/2 nP= 1/2 x 0,4 = 0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là: m = 0,2.(31.2 + 16.5) = 28,4 gam.
Bài 5 SGK Hóa 8 trang 84
Đốt cháy hoàn toàn 24 kg than đá có chứa 0,5% tạp chất của lưu huỳnh và 1,5% tạp chất khác không cháy được. Dựa vào tính chất của oxi hãy tính thể tích CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn).
Hướng dẫn giải bài 5:

Bài 6 trang 84 SGK Hóa học 8
Dựa vào tính chất của oxi giải thích tại sao:
a. Khi nhốt một con dế mèn (hoặc một con châu chấu) vào một cái lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn?
b. Người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc chậu bể cá sống ở các cửa hàng bán cá?
Hướng dẫn giải bài 6:
a. Khi nhốt một con dế mèn (hoặc một con châu chấu) vào một cái lọ nhỏ rồi đậy nút kín. Dựa vào tính chất của oxi sau một thời gian ta sẽ thấy con vật sẽ chết dù có đủ thức ăn.
Vì trong quá trình hô hấp của chúng cần oxi cho quá trình trao đổi chất (quá trình này góp phần vào sự sinh tồn của người và động vật). Khi ta đậy nút kín tức có nghĩa là sau một thời gian trong lọ sẽ hết khí oxi để duy trì sự sống. Do đó con vật sẽ chết.
b. Người ta phải bơm sục không khí vào các bể nuôi cá cảnh hoặc chậu bể chứa cá sống ở các cửa hàng bán cá.
Vì cá cũng như bao loài động vật khác cần oxi cho quá trình hô hấp, mà trong bể cá thường thiếu oxi. Do đó cần phải cung cấp thêm oxi cho cá bằng cách sục khí vào bể.

Hy vọng các bạn biết được oxi là gì và các bài tập về tính chất của oxi. Đừng quên share và follow bài viết để TamTheThangLong có thêm động lực chia sẻ kiến thức nữa nhé.
Trên đây là bài viết Tính chất của oxi chương trình lớp 8 – Bài tập minh họa được Tâm Thế Thăng Long chia sẻ và cập nhật mới nhất. Chúc các bạn có những thông tin thật thú vị tại Tamthethanglong.com.